

CORTOTIC 16 ML MALASSEZIA
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO
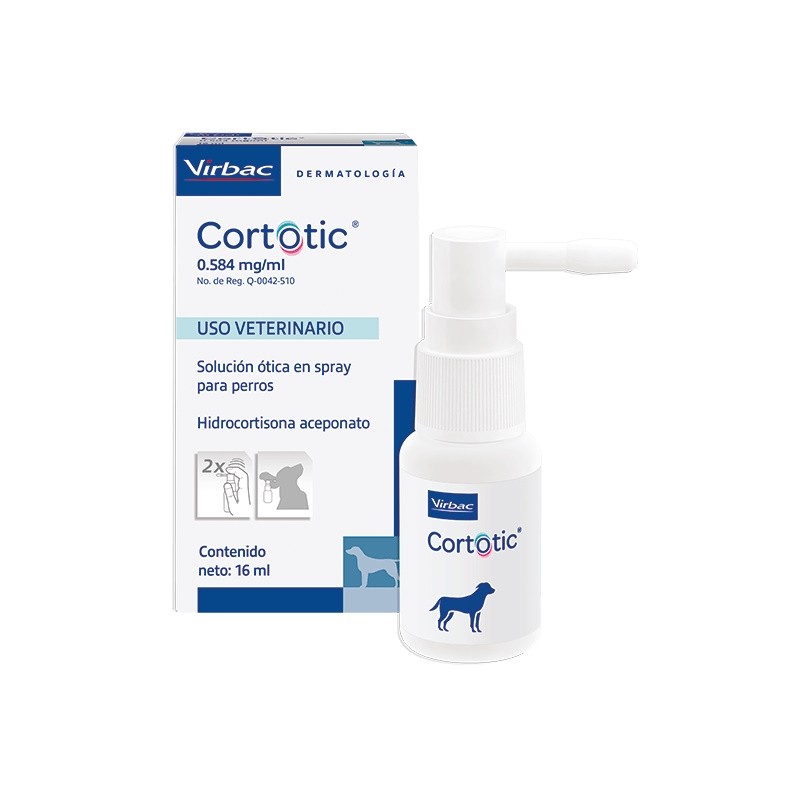
Cortotic 0,584 mg/ml , solución para pulverización ótica para perros
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada ml contiene
Principio activo:
Hidrocortisona aceponato 0,584 mg
Excipientes:
Composición cualitativa de los excipientes y
otros componentes
Propilenglicol metil éter
Solución transparente incolora o ligeramente amarilla
3. INFORMACIÓN CLÍNICA
3.1 Especies de destino
Perros
3.2 Indicaciones de uso para cada una de las especies de destino
Para el tratamiento de la otitis externa eritematosa-ceruminosa aguda.
3.3 Contraindicaciones
No usar en casos de hipersensibilidad al principio activo, a otros corticosteroides, o a alguno de los excipientes.
No usar en animales con la membrana del tímpano perforada.
No usar en casos de lesiones ulcerosas.
3.4 Advertencias especiales
La otitis bacteriana y fúngica es a menudo de naturaleza secundaria. La condición dermatológica subyacente debe ser identificada y tratada.
En casos de otitis parasitaria, se debe implementar un tratamiento acaricida adecuado.
La presencia de cuerpos extraños, tumores y cualquier otra causa inusual de otitis debe descartarse.
En los ensayos clínicos de campo, solo se incluyeron perros diagnosticados con otitis externa con presencia de crecimiento excesivo de bacterias y / o hongos. Se demostró que el medicamento veterinario no era
inferior en el tratamiento de la otitis aguda en comparación con un medicamento tópico de combinación
fija que contenía un corticosteroide, un antibiótico y un antimicótico como principios activos. Se de-
mostró una reducción secundaria del crecimiento excesivo de bacterias y hongos y no fue necesario un
tratamiento concomitante con antimicrobiano.
Por lo tanto, el medicamento veterinario se recomienda como tratamiento de primera elección en la
otitis externa eritematosa-ceruminosa aguda.
3.5 Precauciones especiales de uso
Precauciones especiales para una utilización segura en las especies de destino:
Antes de aplicar el medicamento veterinario, el conducto auditivo externo debe examinarse a fondo para
asegurarse de que el tímpano no está perforado con el fin de evitar el riesgo de transmisión de la infección
al oído medio y evitar daños en el aparato coclear y vestibular.
Evitar el contacto con los ojos del perro sujetando la cabeza del perro para evitar sacudidas. En caso de
contacto accidental, aclarar bien con agua.
No se ha evaluado la seguridad y eficacia en perros menores de 7 meses de edad o que pesen menos de
2,8 kg. En estos casos, el medicamento veterinario debe utilizarse de acuerdo con una evaluación beneficio/riesgo efectuada por el veterinario.
A falta de información específica, el uso en animales que padezcan el síndrome de Cushing o con un trastorno endocrino presunto o confirmado (por ejemplo, diabetes mellitus) o con demodicosis generalizada
se basará en la evaluación riesgo-beneficio.
El medicamento veterinario no ha sido evaluado en otitis externa supurativa ni en otitis externa parásita.
Utilícese únicamente de acuerdo con la evaluación beneficio-riesgo efectuada por el veterinario responsable.
Precauciones específicas que debe tomar la persona que administre el medicamento veterinario a los animales:
El medicamento veterinario es un irritante ocular. Evitar el contacto con los ojos, incluidos los contactos
mano-ojo. En caso de contacto accidental con el ojo, aclarar con abundantes cantidades de agua. Si la
irritación ocular persiste, consulte con un médico inmediatamente y muéstrele el prospecto o la etiqueta.
Esta sustancia activa es potencialmente farmacológicamente activa a altas dosis de exposición. Evitar el
contacto con la piel. Evitar la exposición oral. Colocar de nuevo el frasco en la caja exterior y conservar
en un lugar seguro fuera de la vista de los niños. En caso de contacto accidental con la piel, se recomienda
lavar bien con agua.
En caso de ingestión accidental, especialmente por parte de niños, consulte con un médico inmediatamente y muéstrele el prospecto o la etiqueta.
Lavarse las manos después de su uso.
El medicamento veterinario es inflamable. No rociar sobre llama ni sobre ningún material incandescente.
No fumar mientras se manipula el medicamento veterinario.
Precauciones especiales para la protección del medio ambiente :
No procede
Otras precauciones:
El disolvente en este medicamento veterinario puede manchar ciertos materiales, incluyendo pintados,
barnizados u otras superficies de muebles del hogar.
3.6 Acontecimientos adversos
Perros
Muy raros(< 1 animal por cada10.000 animales
tratados, incluidosinformes aislados).
Inclinación de la cabeza – trastornos del oído
Frecuencia indeterminada Opacidad timpánica*
* * transitorio, reversible y no asociado con deterioro de la audición o sordera
La notificación de acontecimientos adversos es importante. Permite la vigilancia continua de la seguridad
de un medicamento veterinario. Las notificaciones se enviarán, preferiblemente, a través de un veterinario
al titular de la autorización de comercialización o a su representante local o a la autoridad nacional competente a través del sistema nacional de notificación. Consulte también los datos de contacto respectivos
en la última sección del prospecto
3.7 Uso durante la gestación, la lactancia o la puesta
No ha quedado demostrada la seguridad del medicamento veterinario durante la gestación y la lactancia.
Siendo insignificante la absorción sistémica del aceponato de hidrocortisona, es poco probable que ocurran efectos teratogénicos, tóxicos para el feto y tóxicos para la madre a la dosis recomendada en perros.
Utilícese únicamente de acuerdo con la evaluación beneficio/riesgo efectuada por el veterinario responsable.
3.8 Interacción con otros medicamentos y otras formas de interacción
Ninguna
3.9 Posología y vías de administración
Vía ótica .
La dosis recomendada es de 0,44 ml del medicamento veterinario por oído afectado una vez al día durante
7 días consecutivos. Esta dosis se administra con dos pulsaciones de la bomba.
Si el veterinario considera que la condición no está completamente curada en los 7 días, el tratamiento
puede extenderse hasta 14 días. La respuesta clínica máxima puede no observarse hasta 28 días después
de la primera administración.
Instrucciones para un uso adecuado:
Se recomienda limpiar el canal auditivo externo (por ejemplo, mediante el uso de un limpiador auricular)
y secar antes del primer tratamiento.
Se recomienda no repetir la limpieza del oído antes de nuevas aplicaciones.
Antes de la primera administración, retirar la tapa y enroscar la bomba de pulverización en el frasco .
Después cebar la bomba presionándola hasta que se libere el medicamento veterinario. Puede ser necesario un mínimo de 3 presiones.
Introducir la cánula atraumática en el canal auditivo y aplicar el medicamento veterinario mediante dos
pulsaciones de bomba. Sostener el envase en posición vertical mientras se administra el medicamento
veterinario en los oídos afectados.
Mantener la bomba atornillada después de su uso.
Si la bomba no se ha utilizado durante mucho tiempo, activarla una vez antes de volver a aplicar el aerosol.
El volumen del frasco permite el tratamiento de 2 orejas durante 14 días.
1 – Desenroscar la tapa superior 2- Enroscar la bomba al frasco 3- Cebar la bomba
presionando sobre ella hasta que el
medicamento veterinario se libere
4 - Introducir la cánula atraumática en el canal auditivo. Sostener el frasco lo más vertical posible mientras se administra la dosis requerida del medicamento veterinario en el oído o en los oídos afectados
Esta dosis se administra correctamente con dos pulsaciones de la bomba (presionar completamente la bomba hacia abajo para cada presión)
No inclinar demasiado la botella
3.10 Síntomas de sobredosificación (y, en su caso, procedimientos de urgencia y antídotos)
Los estudios de sobredosis por vía tópica mostraron una reducción reversible de la capacidad de producción de cortisol (supresión temporal de la función suprarrenal).
3.11 Restricciones y condiciones especiales de uso, incluidas las restricciones del uso de medicamentos veterinarios antimicrobianos y antiparasitarios, con el fin de reducir el riesgo de desarrollo de resistencias
Medicamento administrado bajo control o supervisión del veterinario.
3.12 Tiempos de espera
No procede
4. INFORMACIÓN FARMACOLÓGICA
4.1 Código ATCvet
QS02BA01
4.2 Farmacodinamia
El medicamento veterinario contiene el principio activo aceponato de hidrocortisona.
El aceponato de hidrocortisona (HCA) pertenece a la clase de diéster de los glucocorticosteroides con una
potente actividad glucocorticoide intrínseca. El medicamento veterinario alivia tanto la inflamación como
el prurito, lo que conduce a una mejora de los signos clínicos de otitis externa y una reducción del crecimiento excesivo de bacterias y hongos.
4.3 Farmacocinética
El aceponato de hidrocortisona (HCA) es un componente lipofílico que garantiza una mayor penetración
en la piel asociada con una baja disponibilidad plasmática y exposición sistémica. Después de la administración tópica o auricular, el aceponato de hidrocortisona se acumula ligeramente en la dermis y la hipodermis del canal auditivo del perro. El aceponato de hidrocortisona se transforma dentro de las estructuras
de la piel. Esta transformación es responsable de la potencia de la clase terapéutica. En animales de laboratorio, el aceponato de hidrocortisona se elimina de la misma manera que la hidrocortisona (otro nombre
para el cortisol endógeno) a través de la orina y las heces.
5. DATOS FARMACÉUTICOS
5.1 Incompatibilidades principales
No procede.
5.2 Periodo de validez
Periodo de validez del medicamento veterinario acondicionado para su venta: 2 años
Periodo de validez después de abierto el envase primario: 6 meses
5.3 Precauciones especiales de conservación
Este medicamento veterinario no requiere condiciones especiales de conservación.
5.4 Naturaleza y composición del envase primario
Frasco de polietileno de alta densidad (HDPE) de 20 ml lleno con 16 ml de solución, cerrado con un
tapón de rosca de HDPE y una bomba de pulverización de HDPE.
Formatos:
Caja con 1 frasco y 1 bomba de pulverización.
5.5 Precauciones especiales para la eliminación del medicamento veterinario no utilizado o, en su
caso, los residuos derivados de su uso
Los medicamentos no se deben ser eliminados vertiéndolos en aguas residuales.
Utilice sistemas de retirada de medicamentos veterinarios para la eliminación de cualquier medicamento
veterinario no utilizado o los residuos derivados de su uso de conformidad con las normativas locales y
con los sistemas nacionales de retirada aplicables al medicamento veterinario en cuestión.
6. NOMBRE DEL TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
VIRBAC
7. NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
4137 ESP
8. FECHA DE LA PRIMERA AUTORIZACIÓN
Fecha de la primera autorización: 01/2023
9. FECHA DE LA ÚLTIMA REVISIÓN DEL RESUMEN DE LAS CARACTERÍSTICAS
DEL MEDICAMENTO
10. CLASIFICACIÓN DE LOS MEDICAMENTOS VETERINARIOS
Medicamento sujeto a prescripción veterinaria.
Encontrará información detallada sobre este medicamento veterinario en la base de datos de medicamentos
de la Unión.